AL MEU AIRE
96
LICORS - SEGRE
Aquest és el meu 96è lliurament en aquesta secció, i m’ha semblat oportú dedicar-lo a un 96 que ens és familiar: el que trobem a l’etiqueta de les ampolles d’alcohol.
L’etanol, que és l’alcohol del vi, dels licors i de farmàcia, és completament soluble en aigua, de manera que podem trobar-los barrejats en qualsevol proporció. Per separat, tots dos canvien d’estat de líquid a vapor (evaporació) i de vapor a líquid (condensació) en les condicions de pressió i temperatura a què estem familiaritzats.
Qualsevol líquid volàtil pur bescanvia molècules amb el seu propi vapor, en un continu evaporar-se i condensar que és la situació d’equilibri. Aquest vapor exerceix una certa pressió que creix amb la temperatura, i per això quan l’escalfem prou perquè la pressió del vapor iguali la de la superfície del líquid, aquest bullirà.
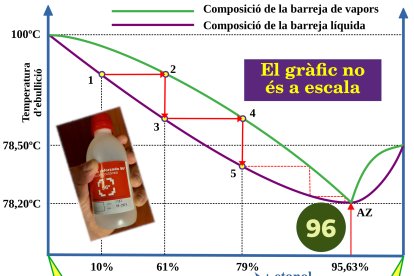
Les olles a pressió poden coure els aliments a més de 100 ºC perquè cal més temperatura per assolir una pressió de vapor més elevada.L’etanol necessita poca energia per evaporar-se, i bull a pressió atmosfèrica a 78,5 ºC, mentre que tothom sap que l’aigua bull a 100 ºC, valor que va servir per construir l’escala de temperatures Celsius, o centígrada, que és la que emprem aquí. Quan els barregem, aquesta diferència de volatilitat es manifesta en una característica essencial per entendre el nostre 96: les dues substàncies són en proporció diferent al vapor respecte al líquid amb el qual estan en equilibri.
Quan destil·lem vi, el vapor que obtenim, i, per tant, el nou líquid obtingut en condensar-lo, és més ric en alcohol que el vi original. Fent-ho de nou, el líquid es va enriquint en alcohol, en una operació que s’anomena destil·lació fraccionada.
Com es veu a la figura, si evaporem un vi [1] amb el 10% d’etanol en massa (el 12% en volum) obtenim un vapor [2] amb el 61%, que si el condensem [3] i el tornem a destil·lar [4] arribarà al 79%, etc.Semblaria que repetint el procés hem d’arribar al 100% d’alcohol, però no és així: pel camí trobem una excepció; una barreja [AZ] en què tant el líquid com el vapor tenen les mateixes proporcions d’aigua i etanol. Són, en pes, el 4,37% d’aigua i el 95,63% d’etanol; arrodonint, el 96%.
Aquesta barreja, anomenada azeotròpica, que bull a 78,2 ºC, no es pot separar per destil·lació. Si partíssim d’una barreja amb més etanol, la destil·lació ens tornaria al punt azeotròpic.
Per enriquir l’alcohol fins a una puresa del 100%, com es demana per determinats usos de laboratori, cal separar-ne l’aigua per altres tècniques.



